- Szilárd-folyékony átalakulás
Az anyagok halmazállapotuk szerint háromfélék lehetnek:
- szilárd halmazállapotúak,
- folyékony halmazállapotúak és
- légnemű halmazállapotúak.
Miközben az anyag egyik halmazállapotból a másikba átalakul, a létrejövő változást nevezzük halmazállapot-változásnak.
Szilárd-folyékony átalakulás
A szilárd anyagok
- melegítés és
- nagy nyomás
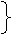
hatására olvadnak meg. Olvadáskor bekövetkező anyagszerkezeti változás
Az olvadás azon a hőmérsékleten játszódik le, amikor a részecskék rezgőmozgásának akkora lesz az amplitúdója, hogy a részecskék egymáshoz ütköznek, és kilökik egymást a rácsszerkezetből. Ilyenkor a kristályrács összeomlik.
Szilárd anyag melegítés vagy nagy nyomás hatására olvad meg.Ábrázoljuk grafikonon a szilárd-folyékony átalakulás során a felvett hőenergia függvényében az anyag hőmérsékletét!
Pl.: -10 °C-os jégből + 10 °C-os víz lesz.
I. szakasz
A szilárd anyaggal közölt hőenergia, a részecskék belső energiáját növeli. Ez abban mutatkozik meg, hogy nő a rendszer hőmérséklete.

II. szakasz
- A befektetett hőenergia a kémiai kötések, felszakítására fordítódik.
- Amíg ez a folyamat tart, addig a hőmérséklet nem változik.
- Azt a hőmérsékletet, amelyen a szilárd anyag az olvadékával egyensúlyban van olvadáspontnak nevezzük.
- A szilárd anyag megolvasztásához szükséges energia egyenesen arányos a szilárd anyag tömegével.
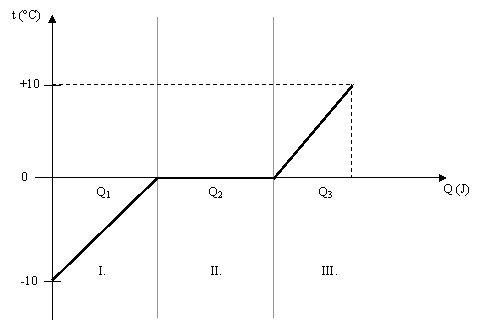
Az olvadáshő megmutatja, hogy az olvadásponton lévő 1 kg tömegű szilárd anyag megolvasztásához mekkora hőenergia szükséges.
Az olvadáshő jele: L0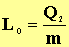
Az olvadáshő L jelölése a latens elnevezésből ered. A XVIII. században az olvadáshoz szükséges hőt latens hőnek, rejtett hőnek nevezték, mivel nem hozott létre hőmérsékletváltozást.
III. szakasz
A befektetett hőenergia tovább növeli a részecskék belső energiáját. Ilyenkor nő a folyadék hőmérséklete.

- Folyékony-szilárd átalakulás
- Ha a folyadék hőmérsékletét csökkentjük, akkor csökken a folyadékban lévő részecskék mozgási energiája is.
- A kis energiájú részecskék összetapadásából kristálygócok alakulnak ki.
- Mivel a kristálygócoknak nagy a tömegük még kisebb lesz a sebességük.
- Ezekhez a kisebb sebességű és nagyobb tömegű kristálygócokhoz tapad hozzá a többi részecske.
- Így nő a kristálygócok mérete, végül egymáshoz érnek. Ekkor szilárdul meg az anyag.
Ha a folyadékban nem alakulnak ki kristálygócok, akkor elő lehet állítani a túlhűtött folyadékot. Ez olyan anyag, amely fagyáspont alatti hőmérsékleten is folyékony halmazállapotú.
A fagyás ugyanazon a hőmérsékleten játszódik le, mint az olvadás. Ezért minden anyag olvadáspontja megegyezik a fagyáspontjával.
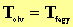
Másrészt 1 kg szilárd anyag megolvasztásához ugyanannyi energiára van szükség, mint amennyi felszabadul, amikor 1 kg folyadék megfagy. Vagyis a fagyáshő az olvadáshő mínusz egyszerese.
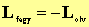
- Folyadék-gőz átalakulás
A folyadékok minden hőmérsékleten párolognak. Magasabb hőmérsékleten intenzívebb a párolgás.
Párolgáskor csak a folyadék felszínéről távoznak el molekulák, míg forráskor a folyadék egészében keletkeznek gőzbuborékok.Forráspont az a hőmérséklet, amikor a folyadék belsejében keletkező gőzbuborékok nyomása eléri a külső légnyomást. A forráspont hőmérsékletén a folyadék és a gőz egymással egyensúlyban vannak.
Tehát a folyadékok forráspontja függ a külső nyomástól. Nagyobb nyomáson adott folyadék magasabb hőmérsékleten kezd el forrni.
Ha a folyadékot melegítjük, akkor nő a hőmérséklete a forráspont eléréséig.
Amikor a folyadék eléri a forráspontot tovább nő a belső energiája, de ez az energia a részecskék közötti másodrendű kötőerők felszakítására fordítódik. (Latens hő)
A forráshő számértéke kifejezi, hogy 1 kg tömegű forrásponton lévő anyag elforralásához mekkora energia szükséges.
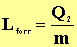
Amikor az összes másodrendű kötés felszakadt, további energia hatására a gőz tovább melegszik.
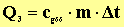
A forrás ellentétes folyamata a lecsapódás, idegen szóval kondenzáció.
1 kg forrásponton lévő anyag lecsapódásakor ugyanannyi energia szabadul fel, mint amennyi 1 kg forrásponton lévő folyadék elpárologtatásához szükséges.
- A gőz és a gáz kapcsolata
.
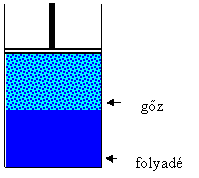
- Ha T1 hőmérsékleten a folyadékkal érintkező gőznek csökkentjük a térfogatát akkor a gőz Boyle-Mariott törvénye szerint viselkedik.
- Ez addig tart, amíg a gőz telítetté nem válik.
- Ha ilyenkor csökkentjük a térfogatát akkor a nyomás nem változik.
- Ez azért van, mert közben a telített gőz lecsapódik.
- Ha az összes gőz lecsapódott akkor további térfogatcsökkenés, óriási nyomásnövekedést okoz.
- Ha magasabb hőmérsékleten is elvégezzük ezt a folyamatot akkor a telített gőz térfogattartománya csökken.
- Lesz egy olyan hőmérséklet, illetve ami felett a gőz már nem cseppfolyósítható. Ezt kritikus hőmérsékletnek nevezzük. E fölött a légnemű halmazállapotú anyagot gáznak ez alatt gőznek nevezzük.
- Néhány érdekes halmazállapot-változással kapcsolatos jelenség
- Forráspont függése a külső nyomástól
- Forraljunk vizet azbeszthálóra helyezett, hosszú nyakú, álló gömblombikban! A forralást folytassuk néhány percig, hogy az edényben lévő levegőt a képződő vízgőz teljesen kiszorítsa! Vegyük el ezután a lombik alól a gázlángot, és egy gumidugóval zárjuk le légmentesen a lombikot! Öntsünk a lombikra hideg vizet! A hideg víztől lehűlt üvegfalon a vízgőz lecsapódik, és a nyomás lecsökken. A kisebb nyomáson - a még mindig meleg víz - újból intenzív forrásba jön.
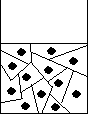
- A kriofor az ábrán látható olyan berendezés,
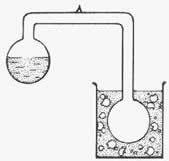 amelyben két üveggömböt felül lévő nyílásuknál vízszintes üvegcső köt össze egymással. Az egyik üveggömbben a kísérlet indulásakor víz van, míg a cső és a másik üveggömb üres. Célszerű a vizet buborék- mentesíteni, és az összekötő csőben lévő levegő nyomását csökkenteni. Ha az üres üvegballont folyékony nitrogénbe helyezzük, akkor pár perc múlva jól látható, hogy a vizet tartalmazó, az előbbitől 20-25 cm távolságban lévő üveggömbben a víz előbb forrásba jön, majd a felszínén 4-5 mm vastag jégréteg képződik.
amelyben két üveggömböt felül lévő nyílásuknál vízszintes üvegcső köt össze egymással. Az egyik üveggömbben a kísérlet indulásakor víz van, míg a cső és a másik üveggömb üres. Célszerű a vizet buborék- mentesíteni, és az összekötő csőben lévő levegő nyomását csökkenteni. Ha az üres üvegballont folyékony nitrogénbe helyezzük, akkor pár perc múlva jól látható, hogy a vizet tartalmazó, az előbbitől 20-25 cm távolságban lévő üveggömbben a víz előbb forrásba jön, majd a felszínén 4-5 mm vastag jégréteg képződik. - A kuktában az étel, pl. hús rövidebb idő alatt megfő. Ennek az az oka, hogy a zárt edényben a gőz nyomása nagyobb, mint a külső légnyomás. Így a víz nem 100 °C-on forr, hanem magasabb hőmérsékleten. A magasabb hőmérsékletű folyadékban a hús hamarébb megfő.
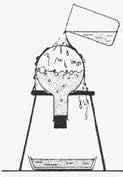
Az edény üresnek látszó részén a víz telített gőze van. A hűtés hatására lecsapódott a gőz, a nyomás csökkent. Ekkor indul forrásnak a víz. A gyors párolgás következtében a nagy energiájú molekulák eltávoznak. A visszamaradó folyadék hőmérséklete egyre csökken, végül megfagy. Így ennek hőmérséklete folyton csökken, míg végül megfagy.
- Nyomás hatása az olvadáspontra
- Egy nagyobb méretű jéghasábot támasszunk fel a két végén, vízszintes helyzetben! Vékony acéldrót két végére rögzítsünk egy-egy 10 kg-os testet, majd az így megterhelt drótot helyezzük az ábrán látható módon a jéghasábra!
- Hasonló jelenséget tapasztalunk korcsolyázáskor is. A nagy nyomás hatására a korcsolya éle alatt a jég megolvad, és a vízen csúszik szinte súrlódásmentesen a korcsolya.
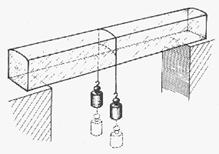
A drót lassan átvágja magát a jégtömbön. A jég a vékony huzal alatt megolvad, a drót lejjebb süllyed, majd a víz a drót fölött ismét jéggé fagy. Ezt a jelenséget nevezik regelációnak, avagy újrafagyásnak.
- A jég olvadáspontjának csökkentése
Egy nagyobb főzőpoharat töltsünk meg félig olvadó jéggel! Ellenőrizzük hőmérővel, hogy a jég-víz elegy egyensúlyi hőmérséklete 0°C!
Keverjünk az elegyhez több kisebb, egyenlő adagban konyhasót (NaCl)! Minden egyes adag után keverjük jól össze az anyagot, és határozzuk meg a hőmérsékletét!
A só hozzáadására a jég-víz elegy hőmérséklete 0 °C alá süllyed. Az olvadáspont-csökkenés az adagolt só mennyiségével arányos.Magyarázat
Kezdetben a víz és a jég egyensúlyban volt. Ezt az egyensúlyt megzavartuk azzal, hogy sót szórtunk a rendszerbe. A rendszer arra törekszik, hogy visszaálljon az egyensúly. Ezért egyre több jégnek kell felolvadni, hogy híguljon az oldat. Az olvadáshoz energiára van szükség, amit a rendszer csak a saját készletéből fedezhet. Ezért csökken a só hozzáadására a keverék hőmérséklete.
- Forráspont függése a külső nyomástól
- Csapadékok a Föld légkörében
A Földet borító tengerek és óceánok víztömege a Föld tömegének 0,25%-a. Egy másik tény, hogy a Föld felszínének 1/3 részét víz borítja. A víz párolgása miatt mindig van vízgőz a levegőben. Csapadék csak a levegő lehűlésével képződhet, hiszen csak így válhat ki a nedvességtartalom. A víz körforgása a földfelszín feletti kb. 10 km magasságban, a troposzférában játszódik le.
A levegő felemelkedését általában a felmelegedés indítja meg.
A meleg levegő kitágul, térfogata megnő, sűrűsége csökken, ezért emelkedik a magasba. Az emelkedő levegő hőmérséklete 100 méterenként 1 °C-kal csökken, addig, amíg el nem éri a harmatpontot.
Harmatpont az a hőmérséklet, amelyen a gőz kicsapódása megkezdődik. Így a harmatpont hőmérséklete függ a levegő páratartalmától.
A harmatponton megkezdődik a felhőképződés, a nedvesség kicsapódása. Ilyenkor 100 méterenként már csak 0,5°C-kal csökken a hőmérséklet. Ennek az az oka, hogy a páratartalom kicsapódásakor hő szabadul fel, ami mérsékli a lehűlést.
Csapadék azokból a felhőkből hullhat, amelyben vízcseppek és jégkristályok is megtalálhatók. A vízcseppek fokozatosan hozzátapadnak a jégkristályokhoz, és amikor a jégkristály akkorára nő, hogy már nem tud a felszálló légáramlásban lebegni, kihull a felhőből. Így valamennyi csapadékfajta jégkristályként indul az útjára.
- Amennyiben a felszín felett lévő levegő hőmérséklete 0°C felett van, a jégkristályok megolvadnak, és eső formájában érkeznek a felszínre. Ilyenkor a vízcseppek mérete 0,7-4 mm átmérőjű.
- Amennyiben a felszín közelében fagyáspont alatt van a hőmérséklet, a jégkristályok nem olvadnak el, és hó formájában érkeznek a felszínre.
- Hódara: a hókristályokat a felhők vízcseppjei vonják be.
- Jégeső általában a legforróbb nyári napokon esik. Ekkor a felforrósodott felszín miatt a levegő nagyon gyorsan emelkedik, és hűl le. Így a páratartalma jég formájában csapódik ki. Ebben az esetben hiába van meleg a felszín közelében, ha a jéggömbök méretük miatt nem tudnak elolvadni a felszínre érkezésig. A jégeső okozta pusztítást úgy akadályozhatják meg, hogy ólom-jodid vagy ezüst-jodid kristályokat juttatnak a zivatarfelhőbe, amelyek kondenzációs magként működve megakadályozzák a nagyobb méretű jéggömbök képződését.
A földfelszín felett keletkező csapadékok
- Ködről akkor beszélünk, ha a vízgőz kicsapódása miatt talajközelben a látótávolság 1 km alá csökken. A köd tehát egy talaj közeli felhő.
- Harmat: az erős éjszakai kisugárzás miatt a lehűlt talajra vízcseppek csapódnak ki.
- Dér: Ha a hőmérséklet csökkenése tovább tart, akkor a kicsapódott vízcseppek megfagynak.
- Zúzmara: Hideg időben a ködöt alkotó vízcseppek túlhűlnek a levegőben, mivel nincs kondenzációs mag. Ha ezek a vízcseppek fagyáspont alatti tárgyakhoz érnek, akkor megkristályosodnak.